Sommario
L’Helicobacer Pylori (HP) è un batterio Gram-negativo a forma di spirale che colonizza lo stomaco. L’infezione da Helicobacter è l’infezione cronica batterica più comune al mondo ed è spesso asintomatica.
Tuttavia in alcuni casi può causare un danno infiammatorio cronico della mucosa dello stomaco (gastrite cronica attiva) fino allo sviluppo di ulcere. Le ulcere possono interessare sia la mucosa dello stomaco che quella del duodeno.
Si stima che circa il 90% delle ulcere duodenali e l’80% di quelle gastriche siano associate a infezione da Helicobacter. L’infezione da HP rappresenta inoltre un importante fattore di rischio per il tumore dello stomaco e per il linfoma gastrico.
Scopri di più su questo patogeno, su come si trasmette, su quali malattie e complicanze causa e sulle possibili terapie.
Helicobacter: che cos’è
L’Helicobacter Pylori è un comune patogeno gastrico Gram-negativo. Si tratta di un microrganismo a forma di spirale che si è adattato a crescere nell’ambiente gastrico, molto acido, grazie a un enzima, l’ureasi, che fa aumentare il pH circostante.
Inoltre la particolare conformazione a elica, da cui deriva il suo nome, gli permette di penetrare lo strato di muco, per insediarsi sotto di esso, dove l’acidità è inferiore.
Grazie ad alcune proteine presenti sulla membrana esterna è in grado di aderire alle cellule epiteliali dello stomaco, danneggiandole attraverso l’espressione di alcuni fattori di virulenza diretti contro l’epitelio dello stomaco e attraverso l’attivazione della risposta infiammatoria.
Helicobacter Pylori: ceppi
Ad oggi sono noti diversi ceppi di Helicobacter Pylori, più o meno virulenti. La principale classificazione è quella che distingue tra ceppi CagA positivi o negativi. Tale definizione deriva dalla presenza, nel genoma del batterio, di una regione codificante per la proteina CagA.
Questa proteina si riscontra mediamente nel 60% dei ceppi batterici occidentali e in circa il 90% dei ceppi batterici asiatici.
La proteina CagA è in gran parte responsabile dell’induzione della risposta infiammatoria cronica. I ceppi CagA+ generano, quindi, una risposta infiammatoria maggiore rispetto ai ceppi CagA negativi, privi di questa proteina.
Oltre ad essere “pro-infiammatoria”, questa proteina è anche definita “oncoproteina” in quanto è coinvolta nel processo di carcinogenesi, cioè quel processo per cui una cellula “sana” si trasforma in cellula neoplastica.
È importante sottolineare come, nonostante le infezioni da ceppi CagA+ siano associate a un rischio maggiore di complicanze (ulcere e tumore dello stomaco), lo sviluppo di tali condizioni deriva da un processo più complesso.
In questo meccanismo entrano in gioco, oltre ad altri fattori di virulenza del batterio, anche fattori ambientali e fattori genetici dell’ospite (l’uomo).
Helicobacter: modalità di trasmissione
Attualmente, l’uomo è l’unico serbatoio noto dell’Helicobacter. Le modalità di trasmissione del batterio non sono ancora chiare. Le più comuni vie di contagio sono quella oro-gastrica e quella oro-fecale. Il batterio è stato isolato nelle feci e in misura maggiore nel vomito, suggerendo tali possibili vie di contagio.
E’ possibile infettarsi anche ingerendo cibi o acqua contaminati. Il batterio può infatti sopravvivere in acqua a temperatura ambiente fino a 10 giorni. Altre possibili vie di contagio sono il contatto con strumenti endoscopici contaminati.
In alcuni Paesi (Perù, Egitto) il batterio è stato trovato nell’acqua della rete di distribuzione. Studi specifici, però, hanno escluso la presenza di Helicobacter Pylori nella rete italiana, dove l’acqua è trattata con cloro.
Helicobacter Pylori: sintomi
L’infezione da HP è in molti casi asintomatica. Secondo dati dell’Istituto superiore di sanità, l’Helicobacter Pylori è presente nello stomaco di circa 25 milioni di italiani, ma nella maggior parte degli individui l’infezione non provoca sintomi.
I sintomi più comuni dell’infezione da Helicobacter sono il bruciore o il dolore nella parte superiore dell’addome (epigastrio) e la cosiddetta “difficoltà a digerire”, cioè la sensazione di stomaco pieno dopo aver mangiato, anche in caso di pasti non abbondanti.
Più raramente possono manifestarsi sintomi come nausea, vomito, perdita di appetito, gonfiore.
In caso di ulcera possono verificarsi sanguinamenti.
Quando l’infezione da HP coinvolge tutto lo stomaco (pangastrite cronica attiva), nel tempo può portare a malassorbimento di alcuni micronutrienti (come ferro e vitamina B12) e quindi ad anemia cronica da carenza.
Habitat e modalità di colonizzazione della mucosa gastrica
La peculiarità dell’Helicobacter Pylori consiste nella sua capacità di insediarsi a livello dello stomaco in condizioni che sono sfavorevoli per la maggior parte dei batteri a causa dell’ambiente fortemente acido (pH ~ 2-4).
La proprietà dell’Helicobacter Pylori di resistere nel lume gastrico è dovuta a due fattori:
- La presenza di flagelli che permettono al batterio di muoversi e attraversare lo strato di muco che sovrasta l’epitelio gastrico per insediarsi sotto di esso e aderire alle cellule epiteliali.
- La capacità di produrre un enzima, “l’ureasi”, grazie al quale neutralizza il pH della cavità gastrica rendendo l’habitat più “confortevole”. L’ureasi scinde l’urea, contenuta abbondantemente nello stomaco, in anidride carbonica e ammoniaca. Quest’ultima neutralizza l’acido prodotto dalla cavità gastrica.
Altri fattori che permettono la colonizzazione e sopravvivenza del batterio a livello dello stomaco sono alcune proteine, presenti nella membrana esterna del batterio, che ne permettono l’adesione alle cellule epiteliali gastriche.
Queste proteine, oltre ad aderire alla mucosa, sono in grado di danneggiare le cellule, sia direttamente, tramite l’attivazione di meccanismi di morte cellulare, sia indirettamente, inducendo uno stato di infiammazione cronica che nel tempo risulta dannoso.

Helicobacter: quali malattie causa
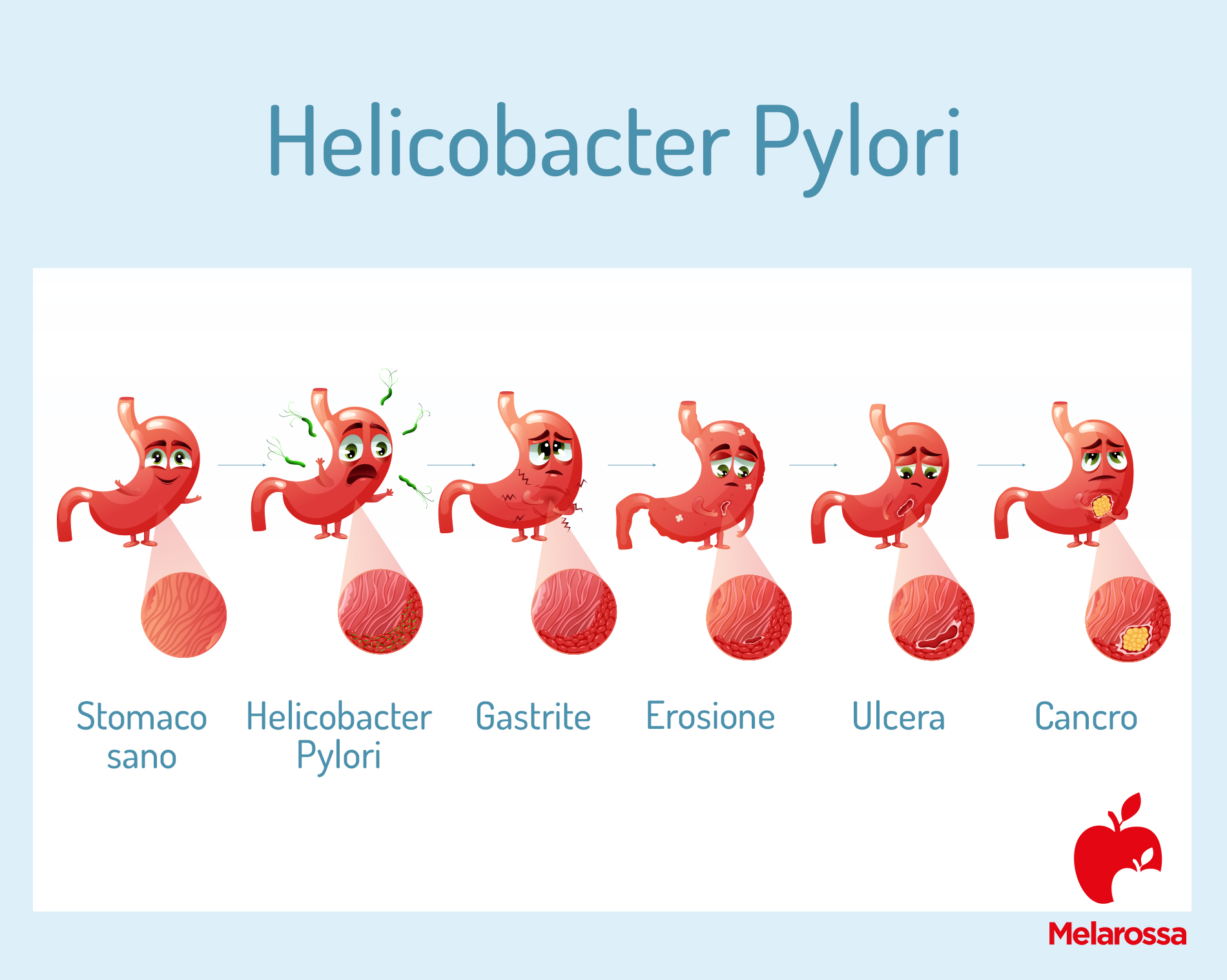
L’infezione da Helicobacter Pylori è la causa più frequente di gastrite cronica attiva e ulcera peptica.
Gastrite
L’Helicobacter Pylori è la causa più importante di gastrite cronica attiva. Quasi tutti i soggetti con infezione da Helicobacter Pylori presentano questa condizione, che può interessare l’intero stomaco oppure solo la sua parte inferiore (antro).
Per gastrite si intende un’infiammazione della mucosa dello stomaco che può essere asintomatica, nella maggior parte dei casi, o sintomatica.
L’infiammazione cronica nel tempo determina l’accumulo di molecole nocive che possono danneggiare le cellule dello stomaco e in alcuni casi, in base a fattori legati sia al batterio che all’ospite (l’uomo), determinano complicanze come la formazione di ulcere (sia nello stomaco che nel duodeno), il linfoma gastrico associato al MALT (tessuto linfoide associato alle mucose, detto anche Maltoma) e il tumore allo stomaco.
Se ti interessa l’argomento, scopri il nostro approfondimento sulla gastrite.
Ulcera gastroduodenale
L’infezione da HP e l’infiammazione cronica che ne deriva possono determinare la gastrite erosiva e portare allo sviluppo di ulcere gastroduodenali, caratterizzate da una lesione di continuo dell’epitelio, che interessa la mucosa dell’apparato digerente esposta all’azione del secreto acido dello stomaco.
L’infezione da HP è ritenuta responsabile dell’80-90% dei casi di sviluppo di ulcere gastriche (se l’erosione interessa la mucosa dello stomaco) o duodenali (se l’erosione interessa i primi centimetri del duodeno).
Per quanto riguarda l’ulcera duodenale, si sviluppa in seguito a un’aumentata esposizione della mucosa del duodeno all’acido, conseguente a un’aumentata secrezione gastrica. Di solito, la localizzazione antrale del batterio favorisce una condizione di ipersecrezione acida che quindi aumenta il rischio di sviluppo dell’ulcera duodenale.
L’ulcera gastrica, invece, si verifica in presenza di gastrite cronica attiva che interessa tutto lo stomaco. In questo caso lo sviluppo dell’ulcera, più che a un’aumentata secrezione acida gastrica, è legato a una riduzione dei meccanismi difensivi della mucosa (tra cui la produzione di muco).
Se ti interessa l’argomento, scopri il nostro approfondimento sull’ulcera.

Diagnosi e test
Per la diagnosi di infezione da Helicobacter Pylori è possibile effettuare diversi esami, più o meno invasivi.
Test del respiro, o breath test
Dopo aver somministrato al paziente dell’urea marcata radioattivamente con carbonio, viene misurata la quantità di anidride carbonica emessa con l’espirazione.
Questo gas costituisce infatti il prodotto metabolico del batterio. La sensibilità e specificità di questo test raggiunge il 94-98%.
È importante che tale test venga eseguito sotto consiglio del medico dopo aver interrotto l’eventuale assunzione di farmaci inibitori di pompa e di antibiotici, in quanto ne potrebbero compromettere l’accuratezza diagnostica.
Test dell’antigene fecale
Questo test consiste nella ricerca dell’Ag di Helicobacter Pylori nelle feci e sembra avere una sensibilità e una specificità simili a quelle dell’urea breath test.
Endoscopia
Durante l’esame vengono prelevati campioni (biopsie) della mucosa dello stomaco, analizzati poi al microscopio alla ricerca del batterio e/o di cellule dell’infiammazione presenti in caso di infezione cronica.
Questo esame è considerato lo standard ottimale per la diagnosi di infezione da HP, di ulcera e di altre complicanze ad essa associate (come condizione pre-neoplastiche e neoplastiche).
Test sierologici
Consistono nella ricerca nel sangue di anticorpi IgG specificamente diretti contro l’Helicobacter Pylori.
Questi test hanno una sensibilità e specificità dell’80%-95%, a seconda del kit utilizzato. Il test può essere usato per la diagnosi di infezione da HP, ma non dovrebbe essere usato per controllare l’eradicazione in quanto la sua positività è indice di infezione, ma non distingue un’infezione “attiva” da una passata.

Cure
Farmaci
La terapia farmacologia dell’infezione è finalizzata all’eradicazione del batterio ed è raccomandata in presenza di complicanze, come ulcera o neoplasia.
Il trattamento consiste in genere in una terapia a base di antibiotici, scelti tra amoxicillina, metronidazolo, tetraciclina o claritromicina, per 1-2 settimane associati a un inibitore di pompa protonica. La scelta della terapia è guidata da eventuali pregresse terapie antibiotiche e dalla resistenza locale agli antibiotici (nello specifico alla claritromicina).
Il trattamento dell’infezione asintomatica è stato controverso, ma il riconoscimento del ruolo dell’Helicobacter Pylori nello sviluppo del cancro ha portato a suggerire la terapia anche in assenza di sintomi.
La scelta del medico in questo caso si baserà sulla presenza di fattori di rischio individuali e sulla valutazione dei benefici derivanti dall’eradicazione dell’infezione. Sono in fase di sviluppo dei vaccini, con effetto sia preventivo che terapeutico (ovvero da impiegare in aggiunta al trattamento dei pazienti infetti).
Dieta
Non ci sono attualmente delle indicazioni dietetiche specifiche in presenza di gastrite cronica attiva. Le restrizioni dietetiche, qualora indicate, dovrebbero basarsi sulla presenza e il tipo di sintomi eventualmente associati.
Complicanze
Helicobacter Pylori e cancro dello stomaco
Circa il 90% dei tumori dello stomaco sono associati all’infezione da HP. L’infezione da HP a lungo termine aumenta il rischio di tumore gastrico: le persone infette hanno infatti da 2 a 6 volte più probabilità di sviluppare un cancro dello stomaco.
È importante tuttavia sottolineare che, sebbene l’infezione da Helicobacter Pylori sia riconosciuta come fattore di rischio per il tumore allo stomaco, lo sviluppo di questa complicanza deriva da un processo più complesso. Fattori ambientali, genetici e propri del batterio (virulenza e durata dell’infezione) hanno tutti un ruolo più o meno conosciuto nel determinare l’aggressività dell’infezione e il rischio neoplastico associato. Tra i fattori ambientali, il fumo di sigaretta sembra aumentare il rischio di sviluppare la neoplasia.
L’Helicobacter Pylori è classificato dall’International Agency for Research on Cancer come carcinogeno di classe I, cioè un agente di cui è riconosciuta la cancerogenicità nell’uomo.
L’infezione da HP determina uno stato di infiammazione cronica e la produzione di sostanze che nel tempo danneggiano le cellule dello stomaco, determinando una serie di modifiche cellulari che possono progredire verso il tumore.
La progressione da gastrite cronica attiva (infezione da Hp) ad adenocarcinoma è stata ampiamente studiata in letteratura. Questo ha permesso di sviluppare delle strategie di sorveglianza volte a individuare ed eventualmente trattare alterazioni della mucosa dello stomaco prima che sviluppi il tumore (le cosiddette condizioni e lesioni precancerose).
L’indicazione alla terapia antibiotica contro il batterio deve sempre prendere in considerazione la presenza di condizioni a rischio di evoluzione in tumore, in quanto è stato dimostrato che l’eradicazione precoce dell’infezione riduce il rischio di sviluppare tumore dello stomaco.
Helicobacter e linfomi
Altre neoplasie associate all’infezione da Helicobacter Pylori comprendono il linfoma MALT (tessuto linfoide associato alle mucose), una rara forma di tumore che colpisce le cellule del sistema immunitario che si trovano a livello dello stomaco.
Fattori di rischio
L’infezione da Helicobacter Pylori può colpire chiunque, ma ci sono dei fattori di rischio, cioè delle condizioni ambientali che favoriscono il contagio.
Tra questi, vivere in un paese con un basso livello socio-sanitario o in un ambiente non igienico. Nei paesi in via di sviluppo, di solito questo batterio viene acquisito durante l’infanzia: in Africa, per esempio, le mamme che hanno l’abitudine di premasticare il cibo prima di passarlo ai bambini possono trasmettere loro l’infezione.
In Italia e nelle maggior parte degli altri paesi sviluppati, invece, con il miglioramento delle condizioni socio-economiche negli anni ‘50-’60 si è verificata una drastica riduzione della prevalenza di Helicobacter nella popolazione generale. Oggi, il batterio è presente nel 40-50% dei soggetti che hanno oltre 60 anni e solo nel 10-20% di quelli più giovani.
Tra le categorie a maggior rischio di infezione rientrano infermieri e gastroenterologi, perché i batteri possono essere trasmessi dagli endoscopi disinfettati in modo improprio.
Ma grazie all’applicazione di adeguate precauzioni igieniche (lavaggio delle mani, disinfezione standardizzata degli strumenti) tale rischio è oggi fortemente ridotto.
Prevenzione
Le informazioni sulle modalità di trasmissione dell’Helicobacter sono ancora piuttosto scarse, quindi non esistono misure specifiche di prevenzione dell’infezione. Di sicuro è utile osservare le comuni regole di igiene personale, prima tra tutte lavarsi bene le mani.
E’ importante anche lavare bene gli alimenti e bere acqua sicura, non a rischio contaminazione.
Storia
L’Helicobacter Pylori si trova in circa la metà della popolazione mondiale. La prevalenza dell’infezione è maggiore nei paesi in via di sviluppo.
La sua presenza è stata osservata solo alla fine degli anni Ottanta. Prima di allora, l’ambiente dello stomaco era considerato troppo acido per la sopravvivenza di germi.
Questa credenza errata ha fatto sì che, quando l’Helicobacter Pylori fu individuato per la prima volta in tessuti gastrici provenienti da interventi chirurgici o da gastroscopie, si pensò a un errore o a una contaminazione.
Furono Barry Marshall e Robin Warren, due ricercatori australiani, a ipotizzare che questo batterio potesse effettivamente trovarsi nello stomaco e ad approfondirne gli studi. Si deve a loro il nome Helicobacter Pylori, dovuto alla sua forma a spirale e al fatto che prediliga proprio il piloro, il punto di passaggio dallo stomaco all’intestino.
Helicobacter e ulcera gastrica: la scoperta del legame
E’ servito del tempo anche per riconoscere il ruolo dell’Helicobacter nello sviluppo dell’ulcera gastrica. Per tutto il ventesimo secolo, infatti, si è creduto che fosse causata prevalentemente dallo stress o, talvolta, dall’assunzione di cibi acidi o molto piccanti.
Il merito di questa associazione va sempre ai due ricercatori australiani e al loro impegno per superare lo scetticismo dei medici, che non credevano a un’origine infettiva di questa patologia. Per dimostrarla, Marshall si autoinfettò bevendo il brodo di una coltura batterica, quindi si ammalò di gastrite, isolò il batterio dalla sua ulcera e guarì con una terapia antibiotica.
Solo nel 1994, il National Institute of Health (NIH) americano dichiarò l’esistenza di una stretta relazione tra l’ulcera gastroduodenale e l’infezione da Helicobacter. Nel 1996 la Food and Drug Administration (FDA) ha approvato negli Stati Uniti il primo trattamento antibiotico specifico.
Nel 2005, Marshall e Warren sono stati insigniti del Nobel per la medicina proprio grazie alla scoperta dell’Helicobacter.
Sempre nel 1994, l’International Agency for Research on Cancer (IARC) ha incluso l’Helicobacter tra gli agenti cancerogeni, riconoscendo il suo ruolo nello sviluppo dei tumori dello stomaco.
Fonti
Revisione scientifica a cura della dottoressa Carlotta Sacchi, specializzanda in gastroenterologia.