Sommario
La SLA o Sclerosi Laterale Amiotrofica, conosciuta anche come malattia di Lou Gehrig, è una malattia neurodegenerativa progressiva. Colpisce gli adulti ed è causata dalla morte dei motoneuroni spinali, bulbari e corticali.
E’ la più comune patologia motoneuronale: colpisce 1,7 persone ogni 100.000 ogni anno, prevalentemente di età compresa fra 50 e 60 anni. Pur essendo una malattia rara, gode di una certa popolarità, anche legata al fatto che ne sono stati colpiti personaggi in vista del mondo dello sport (come il campione di baseball Lou Gehrig, di cui la patologia porta il nome) e della scienza (come il fisico Stephen Hawking).
Nella sclerosi laterale amiotrofica, per cause non ben note, si instaura nel sistema nervoso del soggetto colpito un processo infiammatorio che porta alla perdita dei motoneuroni. Il risultato è la paralisi dei muscoli volontari, inclusi quelli che partecipano al mantenimento di funzioni vitali come quella della respirazione.
Nella fase iniziale e intermedia, i sintomi sono per lo più riferibili al deterioramento della capacità di movimento, che si esprime con la comparsa di crampi, contrazioni muscolari involontarie e fascicolazioni. Invece, nella fase tardiva, viene penalizzata la funzione respiratoria. L’insufficienza respiratoria è la causa più frequente di morte nei pazienti, la cui aspettativa di vita varia fra i 3 ed i 5 anni dalla diagnosi.
La causa della SLA è per lo più ignota. Solo nel 5-10% dei casi si riconosce una correlazione con una mutazione genetica.
Malgrado l’elevato numero di studi nei quali è impegnata la comunità scientifica mondiale, non è disponibile una terapia risolutiva per questa malattia. Esistono due farmaci approvati, ma entrambi hanno indicazioni limitate e producono un aumento esiguo della sopravvivenza dei pazienti.
La terapia della SLA è quindi di supporto, assistenza e mirata al trattamento dei sintomi. Il 21 giugno si celebra la Giornata mondiale della Sla.
SLA o Sclerosi Laterale Amiotrofica: che cos’è
La SLA è una malattia neurodegenerativa progressiva dell’età adulta, determinata dalla morte di una categoria specifica di neuroni e che conduce alla paralisi progressiva dei muscoli volontari fino a coinvolgere anche quelli respiratori.
E’ la più comune fra le malattie dei motoneuroni, un gruppo di disturbi che, per la specifica collocazione anatomica di queste cellule, coinvolgono sia il sistema nervoso centrale che quello periferico. I motoneuroni sono neuroni che conducono lo stimolo nervoso al movimento fino alla muscolatura volontaria di tutto il corpo.
Nel nome della patologia sono già contenuti molti dei suoi aspetti caratteristici.
Per ragioni non ancora chiarite, si verifica una serie di eventi che portano alla morte dei motoneuroni, fenomeno che interrompe l’innervazione dei muscoli volontari e genera la perdita degli stimoli di crescita e proliferazione. In un certo senso, è come se alle fibre muscolari mancassero i fattori nutritivi.
La perdita di fibre assottiglia complessivamente il muscolo e lo indebolisce. Infatti, “a-mio-trofia” significa proprio, dal greco, assenza (a-) di nutrimento (-trofia) per il muscolo (-mio-).
Poiché i motoneuroni si trovano nella parte laterale del midollo spinale, alla malattia viene attribuito questo aggettivo.
Il sistema nervoso sostituisce i motoneuroni morti con tessuto cicatriziale, duro e fibroso: ecco perché nel nome si usa il termine “sclerosi”, ossia irrigidimento.

Chi colpisce la SLA
La SLA ha un’incidenza globale pari a 1-3 casi ogni 100.000 persone ogni anno e colpisce per lo più persone di età compresa tra i 40 e i 70 anni (la frequenza è massima fra i 50 ed i 60). Mentre nella sua forma sporadica l’esordio è più precoce (dai 40 ai 60 anni), quando riconosce una causa genetica anticipa (mediamente è intorno ai 63).
Si stima che in Italia siano presenti più di 6.000 malati, con 1.000 nuovi casi ogni anno. La prevalenza della malattia, globalmente stimata intorno ai 200.000-300.000 casi, è oggi in aumento.
Può colpire anche i giovani?
Esistono rare forme giovanili che compaiono fra i 20 ed i 30 anni. Infatti, è popolare il caso dello scienziato inglese Stephen Hawking, che ha avuto la SLA all’età di 21 anni e ne morì 55 anni dopo.
Colpisce più gli uomini o le donne?
La SLA è più frequente negli uomini che nelle donne (con rapporto di 1,2-1,5), anche se con l’aumentare dell’età, l’incidenza della malattia tende a riequilibrarsi nei due sessi.
È vero che è più frequente in alcuni sottogruppi?
È stata osservata un’elevata incidenza della malattia in popolazioni indigene della Nuova Guinea, dell’isola di Guam e della penisola di Kii in Giappone. Questo aspetto depone per un’origine genetica.
Invece, dei legami fra SLA e fattori di rischio professionale, si è occupata non solo la comunità scientifica ma anche la magistratura. Con un’inchiesta che ha preso in esame i casi di malattia nel mondo del calcio dal 1963 al 2008 il procuratore torinese Raffaele Guariniello si è occupato della maggior incidenza della malattia fra i calciatori.
Lo scopo era quello di accertare se potesse sussistere un nesso con le sostanze utilizzate per il mantenimento del manto erboso dei campi da gioco.
Dagli approfondimenti è emerso che la SLA è 24 volte più frequente fra i calciatori che nel resto della popolazione, un dato che ha orientato la ricerca verso nuove direzioni e ha stimolato la nascita di associazioni pazienti nell’ambito del mondo calcistico.
L’ex centrocampista della Juventus Massimo Mauro è presidente di AISLA Onlus e ha dato vita con l’ex collega Gianluca Vialli alla Fondazione Vialli e Mauro per la Ricerca e lo Sport.
Fra i calciatori famosi colpiti dalla malattia, tutti ricordiamo Stefano Borgonovo, ex attaccante del Milan, morto a 49 anni dopo avere fondato l’associazione che porta il suo nome e che continua a raccogliere fondi per la ricerca contro la SLA.
Le forme in cui la SLA può colpire
La forma sporadica della malattia (Sporadic ALS o SALS) è la più frequente e rappresenta circa il 90-95% di tutti i casi. La SLA sporadica non ha una causa nota.
Nel 5-10% dei pazienti viene diagnosticata la SLA familiare (Familial ALS o FALS), causata da una mutazione genetica trasmissibile.
Malgrado la diversa origine e lievi scostamenti nell’età di esordio, la forma sporadica e quella familiare sono clinicamente indistinguibili fra loro.
Sclerosi Laterale Amiotrofica: cosa colpisce e con quali effetti
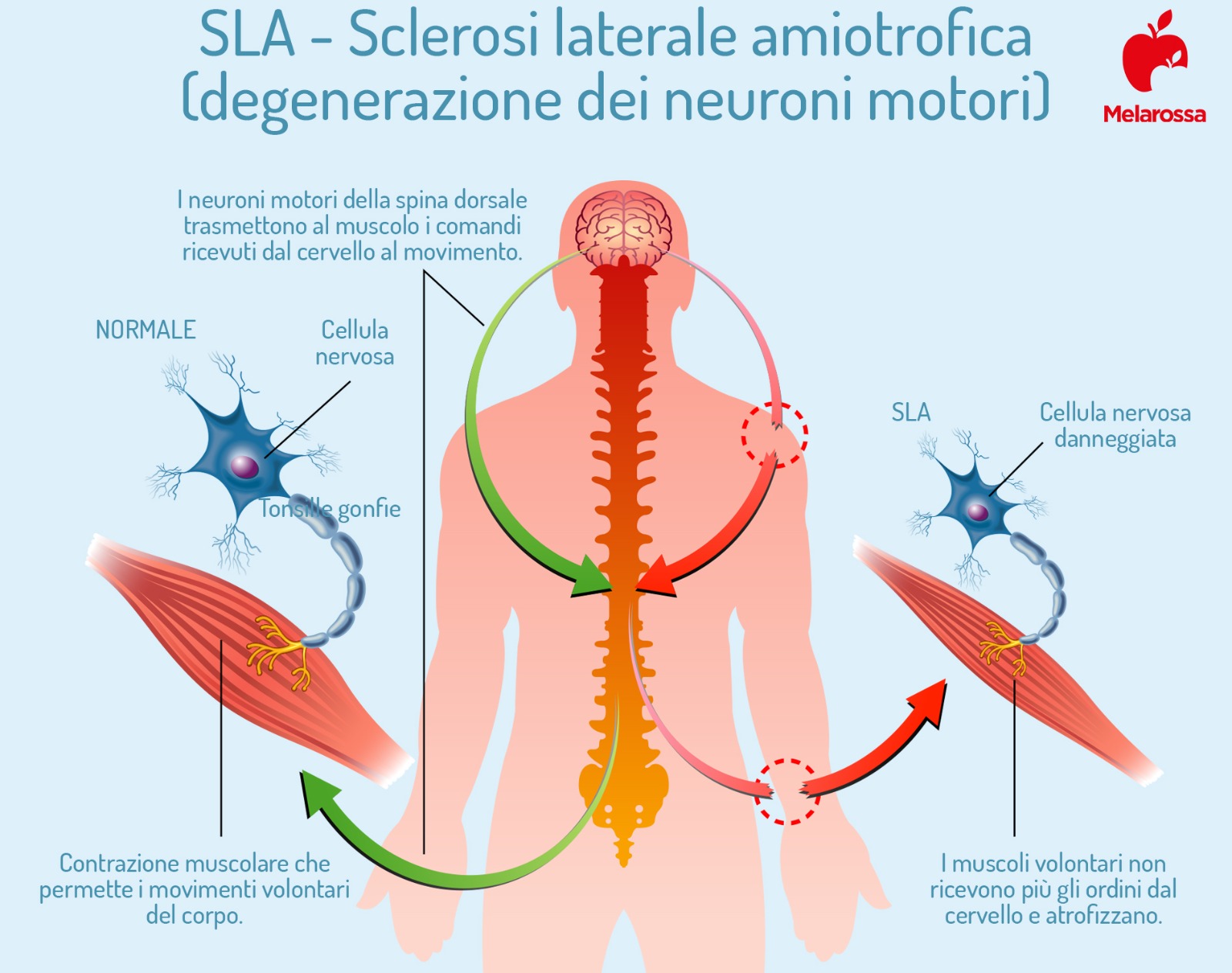
La SLA colpisce i motoneuroni presenti nella corteccia cerebrale (motoneuroni corticali), nel bulbo encefalico (la struttura anatomica che collega l’encefalo al midollo spinale) e nel midollo spinale (motoneuroni spinali).
L’effetto ultimo è quello della paralisi progressiva dei muscoli volontari, che, nella fase tardiva della malattia, coinvolge anche la muscolatura respiratoria.
I motoneuroni sono neuroni che conducono il segnale nervoso dalla corteccia cerebrale (l’area più nobile e recente del sistema nervoso, che ha la funzione di interpretare e integrare le informazioni che arrivano al cervello), verso il midollo spinale e verso i muscoli.
Quando queste cellule muoiono, il segnale elettrico smette di circolare e i muscoli, gli effettori finali di tutta la catena, non si contraggono più: si ha, cioè, la paralisi.
Se questo stato di inattivazione si protrae per un lungo periodo, il muscolo perde fibre, si assottiglia e si indebolisce, ossia si atrofizza. Nel paziente colpito da SLA è visibile il deperimento muscolare prodotto dall’atrofia.
Le conseguenze della morte dei motoneuroni
L’atrofia dei muscoli della testa e del collo causa difficoltà nell’articolazione del linguaggio (disartria) e nella fonazione. La voce può cambiare timbro e diventare roca.
Le difficoltà che subentrano nella deglutizione (disfagia) sono particolarmente insidiose, perché possono provocare fenomeni di soffocamento.
A causa del coinvolgimento dei muscoli respiratori, il paziente ha anche difficoltà nella respirazione (dispnea).
L’alterazione dell’innervazione muscolare provoca fenomeni di spasticità. L’aumento patologico del tono muscolare a riposo è alla base della rigidità e impaccio motorio.
La SLA intacca le facoltà psichiche e intellettive?
Le capacità cognitive e sensoriali vengono generalmente preservate, anche se il 50% circa delle persone affette da SLA può sviluppare difficoltà di apprendimento e deficit di concentrazione.
Cos’è la demenza fronto-temporale?
Nel 15% dei casi, la malattia esprime gravi alterazioni cognitive e comportamentali che vengono inquadrate dal punto di vista diagnostico come demenza frontotemporale (FTD). La FTD è una patologia neurologica che mostra una serie di analogie con la SLA.
Le due malattie condividono la formazione di accumuli patologici di proteine all’interno dei motoneuroni, che potrebbe rappresentare una delle cause di questi disturbi.
Insieme all’Alzheimer, caratterizzato dai depositi di amiloide, formano la triade delle cosiddette “proteinopatie”.
Come si sviluppa la SLA
Non essendo note le cause che portano all’insorgenza di questa malattia, la sua patogenesi non è chiara. Esistono, però, diverse teorie a riguardo.
La più nota e accreditata è quella dello stress ossidativo. A causa di una mutazione genetica (come accade nelle forme familiari di SLA) o di altri fenomeni si creerebbe un’anomalia negli enzimi che hanno funzione di detossificare la cellula.
L’accumulo di prodotti di scarto genererebbe un eccesso di radicali liberi, che finirebbero, direttamente e indirettamente, per uccidere il motoneurone.
È, inoltre, possibile che il problema iniziale sia un’alterazione del metabolismo proteico dei motoneuroni. Quest’ipotesi è legittimata dalla presenza degli accumuli di proteine comune alle tre malattie neurodegenerative sopra citate.
Fra le strade più battute nell’ambito della ricerca, anche quella delle disfunzioni nei meccanismi di regolazione energetica della cellula (teoria mitocondriale).
Secondo altre ipotesi, i motoneuroni verrebbero uccisi da un eccessivo rilascio nel sistema nervoso di sostanze con azione stimolante, un fenomeno noto come eccitotossicità, oppure da uno stato di infiammazione protratto nel tempo.
Cosa sono i motoneuroni
I motoneuroni sono cellule nervose responsabili della contrazione dei muscoli volontari; sono coinvolti nel movimento ma anche in alcune funzioni vitali, come la respirazione.
I motoneuroni trasmettono l’impulso elettrico dall’encefalo (motoneuroni superiori) e dal midollo spinale (motoneuroni inferiori) ai muscoli. In assenza di stimolo nervoso, le fibre muscolari entrano in uno stato di atrofia, che porta all’assottigliamento del muscolo e al suo indebolimento.
Esordio della SLA
In base ai muscoli che vengono interessati per primi dalla degenerazione, la malattia può avere:
- Esordio spinale: è caratterizzato da una perdita asimmetrica di forza negli arti, con ripercussioni sulla deambulazione e sull’abilità nel compiere azioni manuali, come abbottonare una camicia, allacciare una scarpa o scrivere.
- Esordio bulbare: si verifica nel 25% dei casi ed è caratterizzato da difficoltà nel linguaggio dovute a un disturbo muscolare (disartria) e nella deglutizione (disfagia); in questi pazienti le limitazioni al linguaggio possono essere così gravi da impedire l’espressione verbale (anartria). È presente anche una forte labilità emotiva, che rende il malato soggetto a crisi di pianto o di riso incontrollabili. L’evoluzione delle forme ad esordio bulbare porta, comunque, alla compromissione anche della funzionalità dei muscoli degli arti e coinvolti nella respirazione. Le forme ad esordio bulbare hanno generalmente una prognosi peggiore.
Nonostante l’insorgenza possa realizzarsi con modalità differenti, il decorso della malattia nelle fasi più tardive tende ad essere analogo.
SLA: cause
Le cause della sclerosi laterale amiotrofica sono nella gran parte dei casi ignota. Benché per ragioni di chiarezza questi debbano essere trattati separatamente, si pensa che sia l’interazione fra più fattori a generare la malattia.
Fattori genetici
La scienza ha appurato che nel 10% circa dei casi la malattia origina da una mutazione genetica. Sono una trentina i geni potenzialmente coinvolti in questo fenomeno.
Il gene SOD1, il primo ad essere studiato per le sue correlazioni con la SLA e che codifica per una proteina che partecipa ai meccanismi detox della cellula dai radicali liberi, risulta mutato nel 20% circa delle forme familiari e nel 2-3% di quelle sporadiche.
Meno frequenti le alterazioni del gene TARDBP, che codifica per la proteina TDP-43, presente negli accumuli che tipicamente si formano nei motoneuroni dei soggetti con SLA.
Invece, nel 40% circa dei casi di SLA familiare, è il gene C9ORF72 ad essere mutato. L’aspetto importante, oltre alla frequenza di questo fenomeno, è la condivisione della mutazione con la demenza fronto-temporale.
Fattori ambientali
Molti sono i fattori ambientali di rischio per l’insorgenza della SLA.
Oltre agli stimoli fisici rappresentati, ad esempio, dall’esposizione ripetuta a campi elettromagnetici, sono implicati nella patogenesi della malattia anche numerosi composti chimici.
A cominciare dai metalli (alluminio, mercurio, piombo) e da sostanze derivanti dalla combustione delle materie plastiche (come i policlorobifenili) o contenute nei pesticidi.
Anche il fumo da sigaretta è considerato fra i fattori di rischio.
Perché la SLA è più frequente in alcune categorie di professionisti?
In generale, si è osservato che la malattia sembra essere legata anche a condizioni di ipossia.
Quando, per diverse ragioni, come sforzi fisici particolarmente intensi o la permanenza in ambienti poco aerati, l’ossigeno a disposizione dei neuroni scarseggia.
In alcune persone questo fenomeno sembra non essere gestito correttamente. Questo quadro può evolvere verso la degenerazione motoneuronale. Si tratta di un aspetto che potrebbe spiegare l’aumento della frequenza della malattia in alcune categorie di professionisti.
Come anticipato sopra, le connessioni fra il gioco del calcio e l’insorgenza della SLA sono state approfondite anche a causa del numero relativamente elevato di calciatori che si ammalano di questa patologia. In particolare, i centrocampisti sono i più colpiti: questo sembra avvalorare l’ipotesi dell’attività fisica intensa e anaerobica come elemento centrale nella patogenesi.
Dati di particolare interesse sono emersi anche nell’analisi della frequenza anomala di SLA fra gli scalatori e gli alpinisti, che trascorrono periodi di tempo non trascurabili in alta quota: anche per loro varrebbe la teoria sull’ipossia.
Incidenze elevate rispetto alla popolazione generale sono riscontrabili anche fra i pompieri, soggetti a sforzi fisici notevoli.
Ma anche coloro che sono sottoposti all’esposizione a sostanze prodotte dalla combustione di materiali sintetici, come:
- monossido di carbonio
- benzene
- asbesto
- policlorobifenili
- composti policiclici aromatici.
Un legame con lo sviluppo della SLA sembra esserci anche per i traumi: frequenti slogature, distorsioni, fratture, contusioni potrebbero esporre ad un rischio aumentato della malattia.
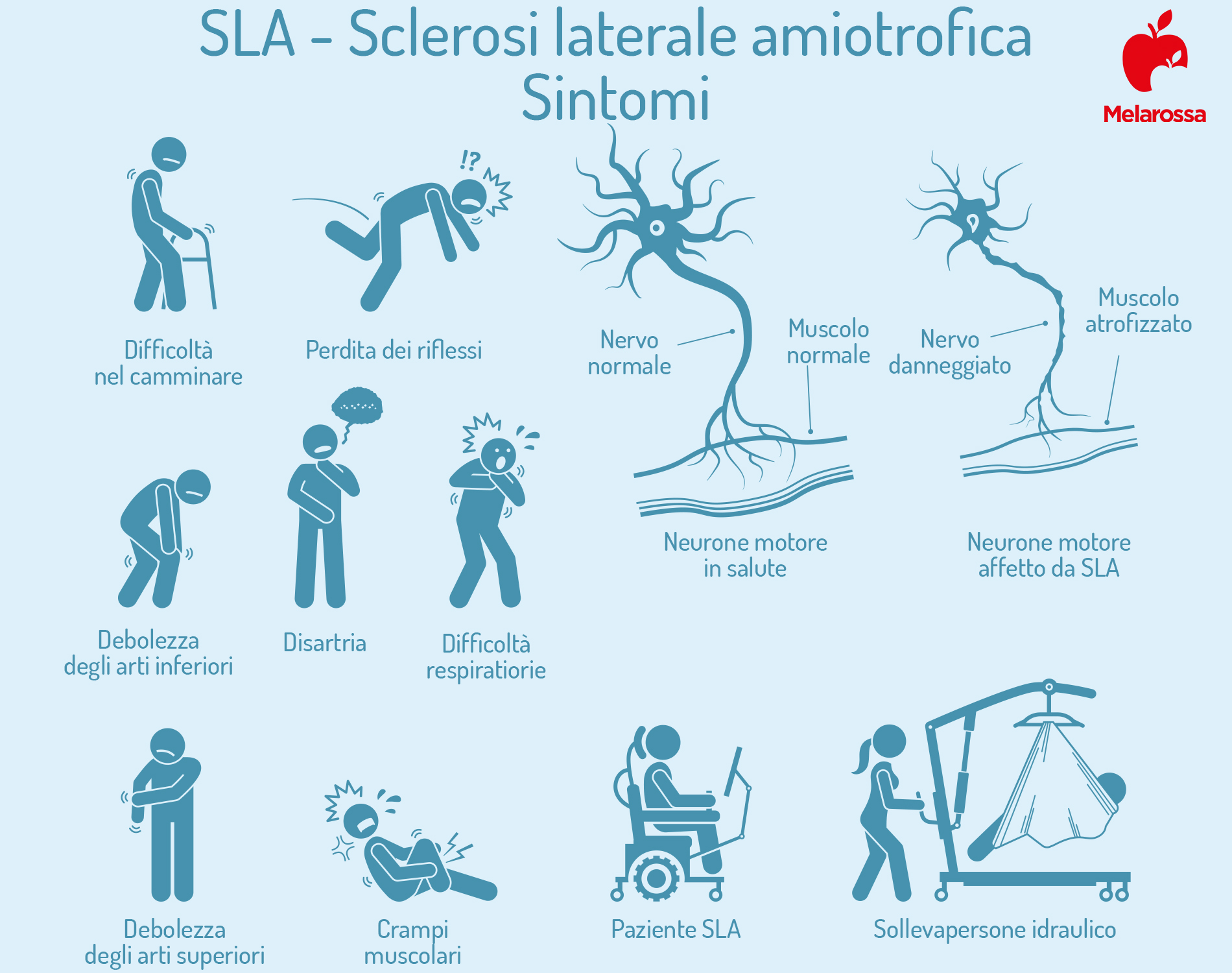
Come si manifesta la SLA
Sintomi precoci
I sintomi iniziali della SLA sono asimmetrici e a localizzazione casuale. Si tratta di manifestazioni sfuggenti, che difficilmente convincono il soggetto che le sperimenta a rivolgersi ad un neurologo.
Ci possono essere difficoltà di origine muscolare nel linguaggio (disartria), peggiorate da un cambiamento nel tono della voce, che può irrochirsi o acquisire un’impronta nasale. Tutto ciò può essere accompagnato da difficoltà nella masticazione e nella deglutizione, per cui il soggetto tende a soffocarsi bevendo.
Il coinvolgimento dei muscoli di testa e collo può determinare l’incapacità di controllare perfettamente l’espressione del viso e dei movimenti della lingua.
Può comparire un deficit di forza muscolare, soprattutto a livello di una mano.
Quali sono i sintomi che compaiono in fase più avanzata
Nel tempo, i muscoli perdono massa (atrofia) e si assottigliano. Le difficoltà nei movimenti sono sempre più pronunciate e subentra un impaccio motorio evidente.
L’alterazione della conduzione elettrica neuromuscolare provoca un’alterazione dei riflessi osteo-tendinei e l’aumento patologico del tono dei muscoli, all’origine dei fenomeni di spasticità che causano rigidità e amplificano le difficoltà di movimento.
Un’altra manifestazione dei disturbi nella trasmissione del segnale nervoso è espressa nelle fascicolazioni, che sono contrazioni rapide e spontanee di uno o più fasci muscolari non associate a movimento.
Nelle fasi più avanzate della malattia compaiono le difficoltà respiratorie e la perdita di peso si fa notevole.
Generalmente le capacità cognitive, di coscienza e sensoriali sono preservate, anche se il 50% circa dei pazienti può sviluppare difficoltà nell’apprendimento, nell’articolazione del linguaggio e nella concentrazione ed una forte labilità emotiva.
Il coinvolgimento di specifiche aree encefaliche provoca crisi emotive intense, che portano a scoppi di risa o di pianto incontrollabili.
Le funzioni che permettono i movimenti volontari degli occhi vengono conservate: individuare i fattori che permettono a queste fibre muscolari di sopravvivere e mantenere la loro funzionalità potrebbe consentire di capire come proteggere anche gli altri muscoli. Vengono conservate anche le funzioni sessuali e sfinteriche.
Il 15% circa dei pazienti sviluppa una forma di SLA intermedia fra questa malattia e la demenza fronto-temporale.
La forma bulbare della SLA
In alcuni casi, la SLA assume aspetti in comune con un’altra malattia neurologica grave, la paralisi bulbare progressiva. Il bulbo encefalico, struttura anatomica situata fra encefalo e midollo spinale, a livello occipitale, è sede di nuclei neuronali fondamentali per la vita, come quelli respiratori.
La variante bulbare della sclerosi laterale amiotrofica è associata ad un deterioramento e un decesso più rapidi. La morte, in questi casi, giunge in un tempo di 1-3 anni dalla diagnosi.
Sono presenti progressive difficoltà nella masticazione, nella deglutizione, nel linguaggio, nella fonazione e debolezza dei muscoli del viso, che porta ad un cambiamento dell’espressione.
Il rischio di inalazione è più elevato rispetto alla forma classica della malattia.

Quali sono le complicazioni
Le potenziali complicanze della SLA sono prevalentemente di tipo respiratorio: la penalizzazione della funzione respiratoria è la causa più frequente di morte dei pazienti. A questo scopo, quando il paziente è in fase avanzata e il rischio di insufficienza respiratoria raggiunge un certo livello, viene predisposta la ventilazione meccanica (non invasiva o invasiva) tramite tracheostomia, ossia l’inserimento di un dispositivo collegato ad un respiratore direttamente in trachea.
Al paziente può anche essere prescritto un farmaco incentivatore della tosse, che lo aiuta a mantenere deterse le vie aeree e a respirare meglio, per quanto possibile. Infatti, la tosse inefficace, sintomo tipico della SLA, rappresenta un serio pericolo di soffocamento.
Il rischio per la vita può derivare dall’insufficienza ventilatoria, ma anche, e soprattutto, dall’aspirazione di particelle di cibo o farmaci o goccioline di bevande. Se queste ultime finiscono nelle vie respiratorie possono causare una polmonite ab ingestis, ad alto rischio per la vita del paziente.
Leggi il nostro approfondimento sull’insufficienza respiratoria.
Fisioterapia respiratoria
La fisioterapia respiratoria è dunque fondamentale per i pazienti affetti da SLA.
Permette un’efficace valutazione clinico-funzionale, consente di impostare un trattamento corretto, ai fini di ripristinare e mantenere un’adeguata ventilazione degli alveoli polmonari. Ma anche:
- facilitare la tosse e la disostruzione bronchiale
- migliorare e mantenere la capacità polmonare e l’elasticità della gabbia toracica
- prevenire la polmonite da aspirazione e da ristagno delle secrezioni
- evitare o posticipare, per quanto possibile, il ricorso alla ventilazione invasiva.

Come si diagnostica la SLA
Spesso i sintomi sfumati della prima fase della malattia non spingono il soggetto ad approfondirne la natura. Mediamente fra l’esordio delle manifestazioni e la conferma della diagnosi trascorrono 10-12 mesi. Quando entra in gioco il neurologo, spesso già il 60-70% dei motoneuroni è perduto e l’efficacia dei farmaci, già debole, può ben poco.
In linea generale, la letteratura scientifica suggerisce che la sclerosi laterale amiotrofica dovrebbe essere sospettata nelle persone che hanno caratteristiche obiettive quali:
- fascicolazioni
- debolezza dei muscoli facciali
- alterazioni specifiche dei riflessi neurologici.
Non esistendo, ad oggi, marcatori biologici della malattia (ossia test diagnostici che permettano con certezza la diagnosi), il riconoscimento della malattia rimane prevalentemente clinico e viene effettuato con il supporto di alcuni esami.
Tutti gli esami che vengono utilizzati per la diagnosi dovrebbero essere ripetuti ogni 6 mesi per valutare l’evoluzione della malattia.
Elettromiografia
L’elettromiografia è un esame che permette di studiare la capacità dei nervi di condurre l’impulso elettrico e di rilevare eventuali disturbi nel funzionamento dei nervi periferici e dei muscoli. Usando piccoli aghi vengono applicate lievi stimolazioni elettriche e registrate le risposte muscolari a valle.
È l’esame che consente di rilevare la SLA con precisione, ma è sensibile anche ad altre patologie. Per questa ragione deve essere effettuato da personale specializzato in centri specifici. La diagnosi è positiva quando si verifica la compromissione di almeno tre distretti nervosi (ad esempio cranio, arti e torace).
Questa procedura fornisce un’indicazione dello stato di sofferenza del motoneurone che non emergerebbe dalla risonanza.
Risonanza magnetica
La risonanza magnetica permette di escludere malattie del sistema piramidale, quella parte del sistema nervoso che coordina i movimenti volontari dei muscoli.
Inoltre, quando non ci sono evidenze di alterazioni messe in luce dall’elettromiografia, può servire ad escludere lesioni strutturali.
Una terza patologia rispetto a cui è possibile fare diagnosi differenziale con la risonanza è la mielopatia spondiloatrosica, un disturbo osseo che altera la conduzione nervosa nel midollo spinale.
Pet
La PET (Tomografia ad Emissione di Positroni) permette di studiare il metabolismo delle diverse aree cerebrali: a seconda di quanto glucosio assorbono i diversi neuroni, si può risalire alla loro attività neurologica.
Come emerso da uno studio italiano, si tratta di un esame con accuratezza diagnostica per la SLA superiore al 95%, che può anticipare la diagnosi di alcuni mesi.
Biopsia muscolare o del nervo
Viene eseguita solo in casi selezionati, quando occorre differenziare la diagnosi fra patologie neuromuscolari.
Implica il prelievo di un campione di muscolo o di nervo, analizzato poi in laboratorio per verificare la presenza di eventuali alterazioni tipiche della malattia.
Esami di laboratorio
Vengono effettuati per escludere altre cause e comprendono la valutazione dell’emocromo con formula, il dosaggio degli elettroliti, di enzimi quali la creatinchinasi, di indicatori di infiammazione come la VES e l’esecuzione dei test di funzionalità tiroidea.
Viene anche verificata l’eventuale presenza di auto-anticorpi, che può segnalare una malattia di tipo autoimmune, come la sclerosi multipla.
Test genetico
Permette di verificare la presenza di una delle mutazioni genetiche correlate alla SLA e supportare la diagnosi di SLA familiare.
In alcuni casi, le mutazioni riscontrate forniscono indicazioni utili sulla prognosi e sulla gestione della malattia.
La possibilità di eseguire il test genetico deve essere discussa con il paziente. Infatti, deve firmare un consenso informato, sia che venga eseguito allo scopo di studiarne la familiarità sia che venga effettuato dopo aver formulato la diagnosi.
La mancanza di terapie valide e di misure preventive efficaci suggerisce che non vi è indicazione all’esecuzione nei pazienti a rischio ma asintomatici.
Può sottoporsi alla valutazione un soggetto a rischio, asintomatico, solo se familiare di un paziente affetto da SLA con mutazione genetica nota.
Ma è importante che i medici chiariscano che un’eventuale positività non è indicativa di un sicuro sviluppo di malattia. Al paziente devono essere fornite informazioni chiare e dettagliate sul significato del test e sulle sue limitazioni.
Il test genetico è costoso e complesso e viene eseguito solo nei centri specializzati (come i Centri NEMO diffusi sul territorio nazionale).
SLA: le terapie disponibili
Nessuna delle terapie farmacologiche disponibili è significativamente efficace.
Ma l’intervento tempestivo e multidisciplinare può rallentare il decorso della malattia e garantire alcuni mesi di sopravvivenza aggiuntivi, soprattutto per quanto riguarda la protezione dal rischio di insufficienza respiratoria.
L’equipe che prende in carico il paziente con SLA è composta da molti specialisti:
- neurologo
- fisiatra
- psicologo
- fisioterapista
- logopedista
- gastroenterologo
- pneumologo
- genetista.
Quali farmaci per la SLA?
Né il riluzolo né l’edaravone, gli unici due farmaci autorizzati per la malattia, offrono sostanziali benefici clinici, ma possono assicurare mesi in più di sopravvivenza.
Il riluzolo, primo farmaco approvato, è un antagonista del glutammato. Cioè contrasta l’eccesso di questa molecola, correlata ai fenomeni di tossicità neuronale, nel tessuto nervoso dei pazienti. Permette anche di posticipare il ricorso alla ventilazione assistita.
Questo medicinale ha efficacia massima nei pazienti giovani nel primo stadio della malattia; non esprime efficacia negli step avanzati. Questa è una delle ragioni per cui occorre anticipare la diagnosi della malattia.
Invece, l’edaravone, autorizzato da qualche anno in Italia, rallenta sensibilmente il declino della funzione motoneuronale nei pazienti che hanno ancora la capacità di svolgere le normali attività. Agisce neutralizzando i radicali liberi, responsabili del danno al tessuto nervoso.
Farmaci sintomatici
I medici hanno a disposizione farmaci che possono aiutare a gestire i sintomi. Malgrado non possano agire sul decorso della malattia, il ruolo di questi medicinali è molto importante, perché contribuiscono a rendere la qualità di vita del paziente un po’ più tollerabile.
La spasticità muscolare può essere tenuta sotto controllo con sostanze come il baclofen o le benzodiazepine (in particolare si usa il diazepam). La spasticità dei muscoli vescicali può causare ritenzione di urina e mettere il sistema urinario a rischio di infezione: per prevenirla viene somministrata l’ossibutinina.
Allo scopo di diminuire la produzione di saliva, che può scolare lungo il mento del paziente (scialorrea) a causa delle difficoltà di deglutizione e dell’indebolimento dei muscoli facciali, si usano gli anticolinergici:
- amitriptilina
- benzotropina
- triexifenidile
- scopolamina
- atropina.
Spesso si verifica reflusso gastroesofageo, a causa dell’indebolimento dei muscoli addominali e del diaframma. In questi casi, vengono somministrati farmaci inibitori della pompa protonica, antiacidi e sostanze che supportano la peristalsi, ovvero la contrazione fisiologica del sistema digerente.
La labilità emotiva può essere trattata con amitriptilina, nortriptilina o fluvoxamina. In presenza di ansia o depressione, vengono usati benzodiazepine o antidepressivi SSRI.

L’assistenza ai malati di SLA
La SLA rappresenta un paradigma nell’ambito delle malattie neurologiche, perché richiede, in più fasi, dalla diagnosi al fine vita, di dare risposta ad interrogativi etici.
L’assistenza ai pazienti con SLA si compone di una serie di interventi eseguiti con approccio multidisciplinare che aiuta ad affrontare la progressione della malattia.
L’assistenza inizia al momento della diagnosi, che deve essere comunicata da professionisti preparati e consapevoli del messaggio che stanno veicolando. E prosegue con la predisposizione del piano terapeutico, l’esecuzione degli esami necessari e il monitoraggio della malattia, mettendo a disposizione strumenti di grande aiuto nella gestione delle problematiche respiratorie e deglutitorie.
In particolare, il ruolo del medico di medicina generale è particolarmente importante nel monitoraggio dell’evoluzione della malattia.
La disartria rappresenta un limite forte alla comunicazione e può favorire la comparsa di sintomi psicologici di ansia o depressione. Per questo può essere utile che il paziente segua un trattamento logopedistico ed esegua una ginnastica respiratoria specifica.
Fondamentale l’istituzione dell’alimentazione artificiale via PEG quando il paziente non riesce più ad alimentarsi per via naturale.
La ventilazione assistita permette di evitare la morte precoce del soggetto per insufficienza respiratoria.
L’assistenza al paziente comprende anche il supporto nell’organizzazione del domicilio con adeguati supporti logistici e la garanzia del contatto telefonico con personale qualificato per pazienti e familiari. La casa, dotata di tutti gli strumenti necessari, è in assoluto il luogo dove il paziente può stare meglio: la degenza ospedaliera dovrebbe quindi essere ridotta al minimo indispensabile.
Nella fase terminale è necessario fornire al paziente assistenza per la gestione del fine vita, con le disposizioni anticipate di trattamento (DAT), attraverso le quali il paziente può scegliere la sedazione palliativa.
SLA e aspettativa di vita
Malgrado l’esordio della malattia possa essere diverso e produrre una sintomatologia iniziale differente, nelle fasi più tardive del decorso le manifestazioni tendono a sovrapporsi.
L’aspettativa di vita dopo la diagnosi è mediamente di 3-5 anni. Circa il 20% dei pazienti vive cinque anni o più; circa il 10% più di dieci anni.
Nonostante questi numeri siano comunque tragici, occorre precisare che la sopravvivenza media si è estesa negli ultimi anni, anche grazie ai miglioramenti nella gestione clinica, nella presa in carico e nella diffusione di supporti tecnologici.
Quali sono i fattori che influenzano la prognosi
I fattori prognostici sono costituiti da:
- età (più è elevata maggiore è il rischio di un decorso peggiore)
- ritardo diagnostico (anch’esso peggiora la prognosi)
- presenza di alcune mutazioni genetiche e deficit cognitivi.
I pazienti che vengono monitorati presso i centri specializzati presenti sul territorio hanno mediamente un decorso migliore.
La causa per cui sopraggiunge la morte
Il decesso è quasi sempre determinato dall’insufficienza respiratoria. Se è vero che l’efficacia dei farmaci è estremamente limitata, comunque l’insieme delle soluzioni (farmacologiche e non) messe in atto dal e con il paziente ne migliorano complessivamente la qualità di vita e riducono il rischio di insufficienza respiratoria.
SLA: cenni storici
La prima descrizione della malattia fu effettuata dallo scienziato e umanista scozzese Charles Bell nel 1824. Una decina d’anni dopo, François-Amilcar Aran studiò un disturbo neurologico caratterizzato da tratti in comune con la SLA e lo definì atrofia muscolare progressiva.
Fu nel 1869 che il neurologo francese Jean-Martin Charcot osservò la correlazione tra la sintomatologia di questa malattia e le alterazioni neurologiche sottostanti. Negli scritti medici che produsse negli anni a venire la rinominò sclerosi laterale amiotrofica.
Il contributo di Charcot allo studio della patologia rimane impresso negli stessi nomi con cui viene tuttora chiamata.
La conoscenza della SLA aumenta grazie ai pazienti in vista
La SLA venne portata alle cronache quando colpì il giocatore statunitense di baseball Lou Gehrig, nel 1939. Gehrig, che morì due anni dopo, non fu solo il primo paziente popolare, ma anche l’origine di uno dei nomi della malattia.
La fama guadagnata dal fisico britannico Stephen Hawking portò definitivamente la sclerosi laterale amiotrofica alla ribalta internazionale. Hawking fu colpito da una rara forma giovanile di SLA e ne morì, nel 2018, a 55 anni dalla diagnosi.
Ci sono popolazioni più soggette al rischio di SLA?
Negli anni seguenti, gli studi si concentrarono intorno all’origine della malattia.
I ricercatori osservarono che la sua incidenza era maggiore in alcuni sottogruppi, come le popolazioni indigene che abitavano l’isola di Guam. Da queste ricerche emersero considerazioni su una possibile eziologia genetica della malattia. Nel 1993, fu identificata la prima correlazione con un’alterazione genetica, in particolare con una mutazione del gene della SOD1, una proteina che esercita sui neuroni un effetto protettivo.
L’approvazione dei farmaci
Nel 1995, fu approvato il primo farmaco per il trattamento della SLA, il riluzolo.
Nel 2006, fu osservata un’importante analogia fra la SLA e un’altra devastante malattia neurologica, la demenza fronto-temporale. In entrambe le patologie si verifica un accumulo patologico di proteine nel tessuto nervoso. Questo fenomeno suggerisce una patogenesi almeno in parte comune.
Nel 2015, l’approvazione da parte dell’FDA americana del secondo farmaco per la SLA, l’edaravone, seguita 3 anni dopo dall’autorizzazione anche del regolatore italiano. Oggi, questo medicinale è rimborsabile dal SSN e indicato per i pazienti con disabilità moderata e buona funzionalità respiratoria.
Fonti
- Cerebrospinal fluid of newly diagnosed amyotrophic lateral sclerosis patients exhibits abnormal levels of selenium species including elevated selenite – M. Vinceti et al – Neurotoxicology, 2013.
- Job strain, hypoxia and risk of amyotrophic lateral sclerosis: Results from a death certificate study – N. Vanacore et al – Amyotrophic Lateral Sclerosis, 2010.
- Manuale di valutazione della comunicazione in ambito di assistenza alle persone con sclerosi laterale amiotrofica – Gruppo CARE – Istituto Superiore di Sanità.
- La gestione delle terapie farmacologiche nei pazienti con SLA – G. Capece et al – Medico e Paziente, 2019.
- Functional pattern of brain FDG-PET in amyotrophic lateral sclerosis – M. Pagani et al – Neurology, 2014.
- Cure palliative nella SLA – M. A. Conte – Rete cure intermedie, palliative e Hospice Aas 5 “Friuli Occidentale.
Ti è piaciuto il nostro articolo? Condividilo su Pinterest.